Похожие новости
20/12/2019
Международная группа учёных синтезировала и изучила соединение, которое поможет значительно удешевить производство светодиодов для получения белого света, имитирующего солнечный. Такие диоды широко применяются в освещении жилых и производственных помещений, для наружной рекламы и выращивания растений предприятиями агропромышленного комплекса.
846
30/11/2017
За одной написанной химической формулой может скрываться сразу несколько различных веществ и структур. Так, оксид железа имеет ряд фаз, и только одна из них позволяет получать магнитные наночастицы для производства, например, более продуктивных жестких дисков.
1278
24/09/2020
Сибирские ученые модернизировали полиэтилен при помощи ультразвука и углеродных нанотрубок. В отличие от изначального материала, полученный композит обладает высокой диэлектрической проницаемостью и большей износостойкостью.
316
21/04/2017
Ученые Сибирского федерального университета и Института физики имени Л.В. Киренского СО РАН разработали технологию синтеза нанодисперсных порошков магния, которые могут стать перспективным материалом для изготовления аккумуляторов водорода для автомобильного транспорта.
2282
16/05/2017
Красноярские ученые получили новый материал для хранения водорода, сообщила пресс-служба Сибирского федерального университета (СФУ). Материал на основе гидрида магния может хранить массу водорода, составляющую около 7% его собственной массы, и это рекордное значение емкости для всех аналогичных материалов.
1645
06/08/2020
Светящийся белок, выделенный из морского рачка Metridia longa, самый маленький из открытых биолюминесцентных ферментов, был впервые использован учеными в тестах на клещевой энцефалит. Одного миллиграмма такого белка может хватить для ста тысяч точных анализов по определению наличия вируса клещевого энцефалита.
604
04/08/2020
Совместный проект ЮНЕСКО и Московского государственного университета имени М.В.Ломоносова — плавучий университет, научно-исследовательское судно «Академик Николай Страхов» вошло в акваторию Баренцева моря, где более 20 студентов из МГУ и других российских вузов при поддержке Министерства образования и науки России будут изучать перспективы нефтегазоносности этого района.
525
10/07/2019
Редакция журнала Physical Chemistry Chemical Physics высоко оценила статью красноярских ученых, выполненную совместно с зарубежными коллегами из Бельгии и Германии. Опубликованная в начале этого года работа, в которой рассматриваются вопросы перемешивания многокомпонентных смесей, попала в число «горячих» результатов — статей с наибольшим цитированием.
667
19/01/2019
Красноярский край — один из самых индустриально развитых регионов России. Благодаря уникальным природным ресурсам в крае преобладают такие отрасли промышленности, как цветная металлургия, электроэнергетика, деревообработка и химическая промышленность.
1357
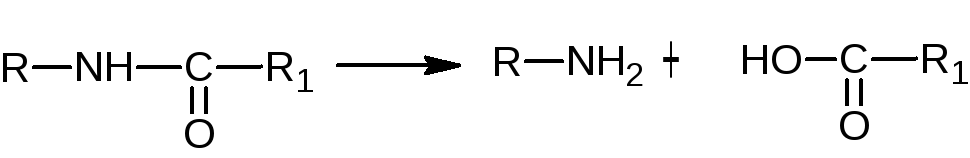
Химические свойства
-
Наличие
амидной
группы
обусловливает свойства веществ вступать
в реакции:
А)
гидролиза
под действием кислот и щелочей с
образованием исходных веществ
аминосоединения
2,4-
или (2,4,6)-замещенного анилина, (содержит
первичную ароматическую аминогруппу,
вступает в реакцию образования
азакрасителя – диазотирования с
последующим азосочетанием, даёт все
реакции на ПААГ) и диэтиламиноуксусной
кислоты
Б)
«гидроксамовой
пробы»
В)
образовывать окрашенные осадки с
солями металлов в щелочной среде после
гидролиза.
-
Наличие
третичного
атома азота
органических оснований (третичная
алифатическая аминогруппа) определяет
основные свойства препаратов и
способность вступать в реакции
солеобразования и комплексообразования.
Оба
препарата применяются в виде солей
хлороводородной кислоты.

-
Лидокаин
и тримекаин являются солями, образованными
слабыми органическими основаниями и
сильной кислотой, поэтому при действии
щелочей легко выделяют в виде осадков
свободные органические основания.
Железо
Железодефицитная анемия в той или иной степени присутствует у 40–60 % женщин детородного возраста по всему миру . И это при том, что железо — один из важнейших микроэлементов, необходимых для нормального функционирования биологических систем организма. Оно требуется для осуществления функции дыхания, кроветворения, участвует в иммунобиологических и окислительно-восстановительных реакциях.
Причины дефицита железа:
- недостаточное поступление в организм железа из-за нарушения режима питания (например, при вегетарианской диете);
- снижение всасываемости железа в кишечнике (рис. 3);
- нарушение регуляции обмена витамина С;
- избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е;
- поступление в организм железосвязывающих веществ;
- усиленное расходование железа (в периоды интенсивного роста и беременности);
- потери железа, связанные с травмами, кровопотерями во время операций, обильными менструациями, язвенными болезнями, донорством, занятиями спортом;
- нарушение функции щитовидной железы;
- различные системные и опухолевые заболевания .
Учитывая высокую распространенность дефицита железа в популяции, сложно говорить о нормальном синтезе коллагена при таких состояниях.
Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
CuS + Cl₂ ―› CuCl₂ + S
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0. Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Похожие новости
21/04/2017
Ученые Сибирского федерального университета и Института физики имени Л.В. Киренского СО РАН разработали технологию синтеза нанодисперсных порошков магния, которые могут стать перспективным материалом для изготовления аккумуляторов водорода для автомобильного транспорта.
2282
20/12/2019
Международная группа учёных синтезировала и изучила соединение, которое поможет значительно удешевить производство светодиодов для получения белого света, имитирующего солнечный. Такие диоды широко применяются в освещении жилых и производственных помещений, для наружной рекламы и выращивания растений предприятиями агропромышленного комплекса.
846
10/07/2019
Редакция журнала Physical Chemistry Chemical Physics высоко оценила статью красноярских ученых, выполненную совместно с зарубежными коллегами из Бельгии и Германии. Опубликованная в начале этого года работа, в которой рассматриваются вопросы перемешивания многокомпонентных смесей, попала в число «горячих» результатов — статей с наибольшим цитированием.
667
06/08/2020
Светящийся белок, выделенный из морского рачка Metridia longa, самый маленький из открытых биолюминесцентных ферментов, был впервые использован учеными в тестах на клещевой энцефалит. Одного миллиграмма такого белка может хватить для ста тысяч точных анализов по определению наличия вируса клещевого энцефалита.
604
19/01/2019
Красноярский край — один из самых индустриально развитых регионов России. Благодаря уникальным природным ресурсам в крае преобладают такие отрасли промышленности, как цветная металлургия, электроэнергетика, деревообработка и химическая промышленность.
1357
24/09/2020
Сибирские ученые модернизировали полиэтилен при помощи ультразвука и углеродных нанотрубок. В отличие от изначального материала, полученный композит обладает высокой диэлектрической проницаемостью и большей износостойкостью.
316
17/07/2020
Группа ученых из Российской академии наук всесторонне изучит экологическую среду территории и представит предложения и рекомендации по наилучшим природосберегающим решениям для деятельности промышленных компаний в Арктическом регионе.
1187
04/08/2020
Совместный проект ЮНЕСКО и Московского государственного университета имени М.В.Ломоносова — плавучий университет, научно-исследовательское судно «Академик Николай Страхов» вошло в акваторию Баренцева моря, где более 20 студентов из МГУ и других российских вузов при поддержке Министерства образования и науки России будут изучать перспективы нефтегазоносности этого района.
525
30/11/2017
За одной написанной химической формулой может скрываться сразу несколько различных веществ и структур. Так, оксид железа имеет ряд фаз, и только одна из них позволяет получать магнитные наночастицы для производства, например, более продуктивных жестких дисков.
1278
Медный синтез
Каждый из нас старается обустроить свой уют, тем более, когда речь идет о доме и о Вашем желании сделать что-то своими руками. Разве не прекрасно, когда Вы можете удивить окружающих своими уникальными произведениями и поймать восторженные взгляды гостей? Итак, сегодня мы рассмотрим как сделать цветок из меди со светодиодной подсветкой и флюоритом внутри.Для начала подготовим все необходимые инструменты. Нам понадобятся: паяльная станция (она лучше, чем просто паяльник тем, что в ней присутствует еще и фен, который пригодится при нагреве и раскатки листов меди), медный лист:

Шаблон цветка (можете сами нарисовать, либо найти и распечатать в интернете), эпоксидка и загуститель для нее, светодиод, маленький кусочек камня флюорита, либо другого, если не желаете, чтоб «сердцевинка» цветка светилась внутри, благодаря светодиоду, два провода, чуть длиннее ствола цветка, пассатижи и 1 батарейку CR2032

Все, можем начинать. Для начала берем листочек меди, размером 10*15 см, прогреваем его феном, либо утюгом и раскатываем его на ровной поверхности. Это будет наш стебель. После этого, кладем в центр листа 2 провода, с предварительно зачищенными краями (они будут припаиваться к светодиоду с одного конца и к батарейкам с другого). Не забываем, что провода должны быть чуть длиннее, чем 10 см. Берем стержень от ручки или другой длинный круглый предмет, прогреваем еще раз медный лист и скатываем лист в трубочку. Наш стебель готов.Приступаем к соцветию и листкам для стебля. Листки распечатываем на бумаге и проводим контур от них на меди, прогреваем медь- вырезаем.






Берем в руки паяльник, олово и припаиваем листки к стволу. Теперь приготовьте 3 или 4 (в зависимости от желаемой «пушистости») листка меди, размером 5*5. По аналогии с листиками, обводим шаблон цветка на меди. Вырезаем их, не разрезая до конца. Кладем наши листы один на другой и пока они еще ровные, но уже с вырезанным цветком, пробиваем в середине насквозь дырочку. Пробить можно чем угодно, это не сложно.Приступаем к самой интересной части. Берем наш стебель с листками, соцветие и паяльник. Провода, которые выходят из стебля, заводим через дырочку в соцветие. Припаиваем соцветие к стеблю. К проводам, находящимся в соцветии припаиваем светодиод. На светодиод приклеиваем флюорит:Теперь поворотом формируем наше соцветие, придавая лепесткам желаемый вид. Начинаем делать теперь подставку для нашего цветка. Возьмите бокал или стопку и обведите его контур на меди.

Вырежьте.Теперь берем вырезаем медную ленту, шириной 1-1,5 см по длине круга. Берем термоклей или эпоксидку и приклеиваем круг к медной ленте, прогревая феном для более быстрого результата. В середине круга пробиваем дырочку и заводим провода со стебля в нее. Припаиваем подставку к цветку. Батарейку припаиваем к проводам и заливаем их в подставку воском.
Готово!Хороших Вам идей и прекрасного настроения!
Реакции подлинности
1.ФСЛекарственные
вещества дают реакцию на
хлорид-ион:
R·
НCl + АgNОз → R·НNОз + AgCl↓
2.ФС
Реакция гидролитического расщепления
с растворами щелочей или кислот,
вследствие которой образуются
2,6-диметиланилин
(лидокаина гидрохлорид) или
2,4,6-триметиланилин
(тримекаина
гидрохлорид). Последние вступают в
реакции диазотирования и образования
азокрасителя:
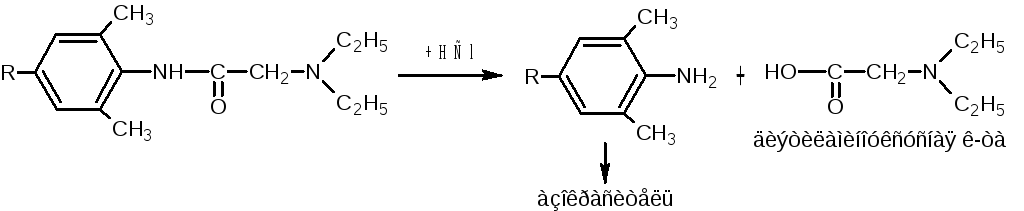
NaNO2
+ 2HCl
— NaCl;
— 2H2O
Cl-
(NaOH)
3.ФС
Реакция отличия тримекаина гидрохлорида
от других местноанестезирующих
средств (на третичный амин)—
комплексообразование.
На
предметном стекле препарат с
0,1 М раствором K2Cr2О7
и H2SО4
разв.
образует
со временем кристаллы в виде игл,
собранные в пучки или веточки
(микрокристаллическая
реакция):
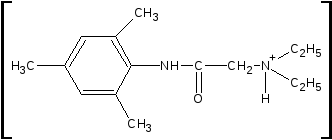
•Cr2O72-
2
4.Лидокаина
гидрохлорид с пикриновой кислотой (на
третичный амин — комплексообразование)
образует пикрат лидокаина, у которого
определяют температуру плавления (около
230 ОС):
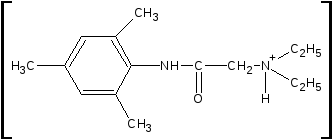
•
5.Реакция
отличия тримекаина гидрохлорида от
других местноанестезирующих средств.
Окисление
тримекаина
гидрохлорида при температуре 155-156 оС
в смеси меди (II)
сульфата и концентрированной серной
кислоты. После
охлаждения смеси и нейтрализации
конц. раствором аммиака появляется
синее окрашивание, а при УФ-облучении
наблюдается красно-розовая флюоресценция.
6.
Реакция
солеобразования с солями меди (II) и
кобальта.
Тримекаина
гидрохлорид
взбалтывают со
щелочью до растворения выделившегося
основания, затем прибавляют раствор
ацетата меди (II);
образуется зелёное окрашивание.
Лидокаина
гидрохлорид
действием щелочи
переводят в основание,
растворяют
в этаноле и прибавляют раствор кобальта
хлорида;
образуется синевато-зелёный осадок.
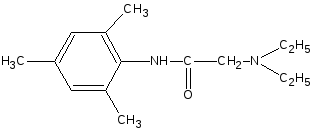
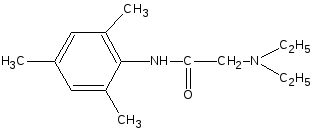
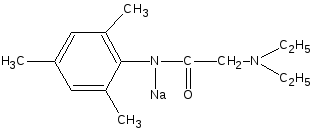
+ NaOH
•
HCl
— NaCl
—
H2O
NaOH
— H2O
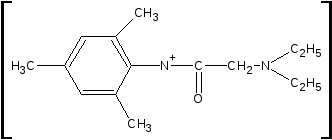
Cu2+
2Cu2+
Цинк
Цинк — единственный металл, представленный в небелковой части ферментов каждого класса, и никаким другим металлом цинк не может быть заменен. Несмотря на малую концентрацию цинка в крови, стабильные связи с макромолекулами делают его доступным для всех тканей организма, что в дальнейшем позволяет удовлетворять потребности в нем белков и ферментов, выполняющих различные биологические функции .
Распространенность дефицита цинка в мире не менее значительная, чем железа и витамина С, и составляет до 60% .
Для транспорта эритроцитами кислорода и углекислого газа абсолютно необходим цинк, и большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов — карбоангидраз. Карбоангидразы катализируют превращения углекислого газа в угольную кислоту (угольная кислота участвует в поддержании pH крови в физиологическом диапазоне (7,25–7,35). В капиллярах легких эти процессы идут в обратном направлении: угольная кислота распадается на углекислый газ и воду, и углекислый газ удаляется наружу .
Без нормального дыхания ни одна клетка не способна осуществлять свои функции.
Важные источники меди
Медь присутствует в таких продуктах питания как печень, мясо, морепродукты, бобовые, цельно зерновые, соевой муке. А также в пшеничных отрубях, миндале, авокадо, ячмене, чесноке, орехах, овсе, мелассе, свекле и чечевице. Устрицы являются самым богатым источником меди в продуктах питания. Содержание меди в продуктах питания со временем уменьшается из-за длительного их хранения в жестяных банках. Либо продолжительного нахождения в продуктовых магазинах, где они подвержены закисанию.
Источником поступления меди в организм человека также может быть питьевая вода, которая течет по медным трубам.
Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
4CuO = 2Cu2O + O2.
В воде оксид меди не растворяется и не вступает в реакции с ней. Обладает слабыми амфотерными свойствами с преобладанием основных.С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
CuO + 4NH3 + H2O = (OH)2.
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
CuO + H2SO4 = CuSO4 + H2O.
Результатом сплавления оксида меди со щелочами является образование купратов:
CuO + 2KOH = K2CuO2 + H2O.
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
- CuO + H2 = Cu + H2O
- CuO + CO = Cu + CO2
- CuO + Mg = Cu + MgO.
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
Cu(OH)2 = CuO + H2O
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
2Cu + O2 = 2CuO.
Получение окиси меди (CuO) своими руками
Получение окиси меди, CuO.
Окись меди используется для окрашивания пламя в синий цвет. Чтобы получить окись меди нам понадобится всего ничего – несколько реактивов, которые легко купить в магазинах.
Реактивы:
1) Медный купорос, CuSO4, сульфат меди. – Приобретается в садоводческих магазинах как средство для борьбы с вредителями.
2) Натрий двууглекислый – под страшным с первого взгляда названием скрывается самая обычная пищевая сода. Продается в продуктовых магазинах 30руб/кг.
Посуда и приспособления:
1) 2хСосуд на 500мл – я использовал две химические колбы на 500мл.
2) Железная банка – просто едим любые консервы и срываем этикетку. Конечно же, перед этим тщательно моем. (Желательно, чтобы банка была без краски, такая вряд ли подойдет т. к. краска при нагревании может загореться или просто будет вонять).
3) Воронка с фильтром – вместо фильтра можно взять обычную вату. Воронку можно взять и обычную пластмассовую, только помыть после употребления. У меня была (к счастью) химическая воронка со стеклянным фильтром. Сей девайс довольно дорогой и продается в хим. магазинах.
4) Немного листов бумаги А4, желательно чистую.
5) Электрическая плитка – чтобы прокаливать продукт.
Этапы приготовления:
1) Отмеряйте соду и купорос в пропорции 1:1 по весу, я взял 10г соды и 10г купороса.
2) Далее наливаем 200-300мл горячей воды в нашу посуду.
3) Растворяем там 10г медного купороса.
4) Затем добавляем 10г соды
Внимание! Когда вы добавите соду, начнется бурное вспенивание раствора и выделение углекислого газа. Вот собственно и реакция: CuSO4+NaHCO3 → Cu(OH)2CO3 + Na2SO4+CO2
5) Дайте раствору отстоятся. На дне вы увидите светло-голубой осадок – Cu(OH)2CO3. С помощью шприца соберите раствор Na2SO4. Затем еще раз залейте в колбу воду и так несколько раз. С помощью этих манипуляций мы очищаем наш продукт от примеси Na2SO4, который растворим в воде.
6) Отделяем наш осадок от раствора путем фильтрации.
7) Полученный продукт небесно-голубого цвета сушим на батарее на листе бумаги.
 Высохший продукт ( у меня он высох на батарее за ночь) ссыпаем в заранее подготовленную консервную банку и ставим на электрическую плитку и ставим на максимум.(Cu(OH)2CO3 разлагается при 200 С).
Высохший продукт ( у меня он высох на батарее за ночь) ссыпаем в заранее подготовленную консервную банку и ставим на электрическую плитку и ставим на максимум.(Cu(OH)2CO3 разлагается при 200 С).
9) Через 3 – 4 часа голубой порошок станет черным. Если он равномерно черный – готово, если нет, пусть постоит еще часик-другой.
10) Полученный черный порошок уже можно использовать по назначению.
Общие сведения
 Покрытие гальваникой бывает технологическим или декоративно-защитным. Это тонкий металлический тонкий слой, который в зависимости от гальванических элементов может выполнять эстетические функции. Гальванопластика не увеличивает прочность изделия, поскольку в этом случае требуются большие производственные мощности, но для красоты и придания «свежести» вполне подойдет.
Покрытие гальваникой бывает технологическим или декоративно-защитным. Это тонкий металлический тонкий слой, который в зависимости от гальванических элементов может выполнять эстетические функции. Гальванопластика не увеличивает прочность изделия, поскольку в этом случае требуются большие производственные мощности, но для красоты и придания «свежести» вполне подойдет.
Гальванические реакции происходят с помощью постоянного электрического тока. В специальную емкость-диэлектрик наливают раствор — электролит, в который погружают два анода. Аноды должны быть изготовлены из металла, который будет осаждаться на покрываемом изделии.
Обрабатываемая деталь присоединяется к минусовому выводу и помещается между анодами. Она выполняет роль катода. Аноды, в свою очередь, присоединяются к плюсовому контакту источника питания. Они становятся частью цепи, проводя ток в электролит и отдавая ему свои металлические элементы. Электролит передает необходимые частицы обрабатываемой детали, они постепенно обволакивают её тонким слоем. Аноды по площади должны превышать в несколько раз размер заготовки.
Другими словами, гальванизация представляет собой перенос молекул металла раствора на изделие в момент протекания через них электротока.
Любой гальванический процесс можно разбить на общие этапы:
- Сборка гальванической установки.
- Подготовка электролитного раствора.
- Обработка и подготовка образца.
- Запуск гальванического процесса.

Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.Совсем по-другому протекают реакции получения меди методом окислительного обжига. Этим методом обогащают медные руды, в составе которых имеется существенное количество серы. Для реализации этой технологии необходимо нагреть руду до температуры 700–8000 градусов. Под действием таких высоких температур происходит окисление сульфидов, и объем серы в медной руде снижается почти в два раза. Следующим этапом является расплавление обогащенной руды в отражательных или шахтных печах при температуре 14500. Результатом этого расплава является образование штейна – сплава, который состоит из сульфидов меди и железа.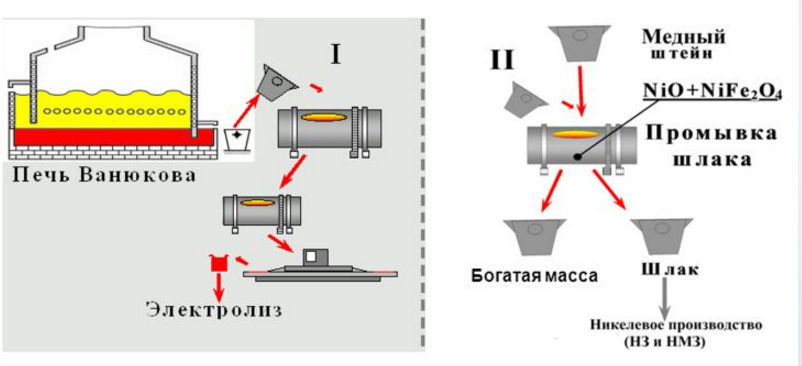 Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO2.Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO2.Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
Аскорбиновая кислота (витамин С)
Аскорбиновая кислота играет в организме фундаментальную роль — нет фактически ни одного физиологического процесса, в котором бы она не принимала участия.
Роль витамина С в организме
Аскорбиновая кислота в организме человека оказывает влияние на множество важнейших биологических процессов:
- образование кортикостероидов (при стрессе в несколько раз возрастает уровень потребления витамина С тканями и органами) ;
- обмен тирозина (влияние на обмен гормонов щитовидной железы) ;
- трансформация дофамина в норадреналин ;
- превращение токсичных соединений ванадия в безвредные ;
- превращение фолиевой кислоты в ее активную форму — тетрагидрофолат ;
- активация мРНК ацетилхолинового рецептора ;
- образование активных форм витамина D (транспортной формы — в печени и активной гормональной формы — в почках), что служит основным фактором профилактики остеопороза ;
- потенцирование всасывания железа .
Распространенность дефицита витамина С в мире по разным данным составляет 20–40% .
В последнее время много исследований посвящено аскорбиновой кислоте и ее биодоступности для кожи . При недостатке витамина С в организме его нанесение на кожу не будет иметь ожидаемого эффекта, так как не сможет восполнить нутритивный дефицит. В ходе проведенных исследований выяснилось, что витамин С ускоряет заживление ран, участвует в активизации синтеза коллагена I типа (рис. 5) и снижении параметров
окислительного стресса. Никаких значимых побочных эффектов при добавлении витамина С в питание в ходе проведенных исследований выявлено не было .
Соединения Меди (II)
Окись меди (II) CuO встречается в природе в виде черного землистого продукта выветривания медных руд (мелаконит). В лаве Везувия она найдена закристаллизованной в виде черных триклинных табличек (тенорит). Искусственно окись меди получают нагреванием меди в виде стружек или проволоки на воздухе при температуре красного каления или прокаливанием нитрата или карбоната. Полученная таким путём окись меди аморфна и обладает ярко выраженной способностью адсорбировать газы.
Также встречаются соединения: дигидроксокарбонат меди (горная зелень) Cu2(OH)2CO3 тёмно-зелёные кристаллы. Образуется в зоне окисления медных месторождений.
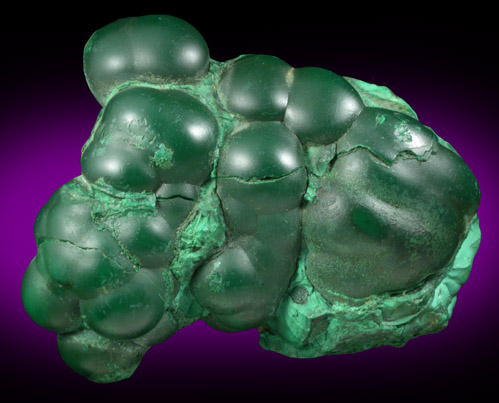
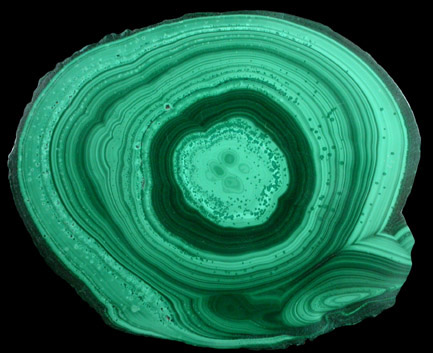
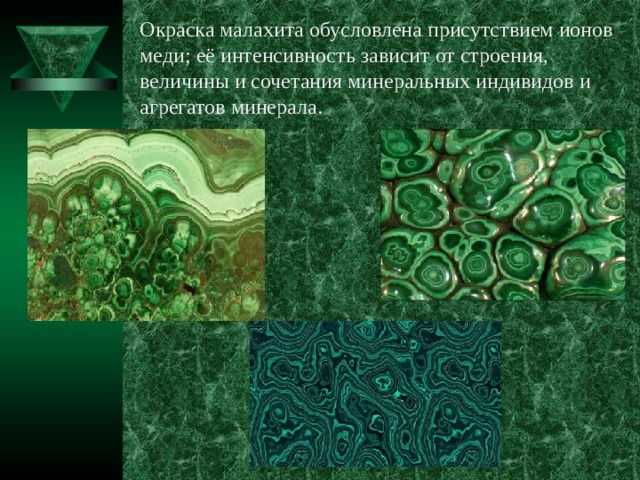
Физические свойства малахита
Название: основный карбонат меди, малахит, медная зелень, малахитовая зелень, плисовый малахит, атласная руда, павлиний камень, (CuOH)2CO3 — довольно хрупкий минерал.
Цвет: варьирует от сочного темно-зеленого до светлого бирюзово-зеленого. Непрозрачен, в мелких кристаллах просвечивает. В плотных почковидных агрегатах окраска обычно распределяется ритмично, с чередованием темных и светлых зон. Тонкоигольчатый (плисовый) и порошковатый агрегаты окрашены равномерно. Более или менее одноцветные куски встречаются редко.
При нагревании до 150?C не изменяется, при 200?C реактив разлагается и чернеет, переходя в CuO. Нерастворим в воде, растворяется в кислотах с образованием соответствующих медных солей, а также в водных растворах цианидов, солей аммония в щелочных карбонатов с образованием комплексных соединений меди.
Химические свойства малахита
Состав малахита отвечает формуле Cu2H2CO5. Всесторонние исследование привели к более содержательной формуле: Сu2 (ОН)2СО3. С учетом современных знаний о составе ионных кристаллов мы можем записать формулу малахита:
2^2+CO3^2-
Состав малахита различные авторы выражают идентично (имея в виду ионный состав кристалла): у Н.С.Ахметова — СuСО3*3Сu(ОН)2, у Д.И.Менделеева — СuO2H2CuCO3.
Рассмотрим реакцию разложения малахита:
(СuОН)2СО3=2CuOv + CO2^ + H2O(180-200?C)
(СuОН)2СО3+ K2CO3 = K2 + Cu(OH) 2v.
((СuОН)2СО3+ 4CH3СООН = 2Cu(CH3COO) 2+ CO2^ + ЗH2O.
(СuОН)2СО3+ 4HCl (разб.) = 2CuCl+ CO^ + 3HO
(СuОН)2СО3+ 4NHCl (конц.) = 2CuCl+ CO^ + 3HO + 4NH^ (кип.)
(СuОН)2СО3+ 8(NH•HO) [кoнц.] = CO+ (OH) + 8HO
(СuОН)2СО3+ 8KCN (конц.) = 2K + KCO+ 2KOH
(СuОН)2СО3+ 3CO+ 4KOH (разб.) = 2K (син.) + 3HO
(СuОН)2СО3+ CO = 2CuCO (бел.) + HO (180?C, p)